癌症疫苗通过激活细胞毒性T淋巴细胞(CTLs)来攻击肿瘤细胞,但其效果常因免疫原性不足、抗原呈递效率低以及肿瘤微环境(TME)的免疫抑制特性而受限。为克服这些挑战,作者开发了一种病毒模拟纳米疫苗(cGAMP@vEVs),通过工程化肿瘤细胞来源的细胞外囊泡(tEVs),使其表达病毒相关蛋白(VSVG和CRT),并加载STING通路激活剂cGAMP,以增强抗肿瘤免疫反应。
cGAMP@vEVs通过VSV感染肿瘤细胞制备,加载cGAMP后展现出良好的稳定性。体外实验表明,cGAMP@vEVs能够被同源肿瘤细胞和树突状细胞(DCs)高效摄取,显著激活STING通路,促进IFN-β产生,增强DCs成熟和T细胞激活。体内实验表明cGAMP@vEVs在肿瘤和淋巴结中高效积累,显著增加肿瘤内CD4+和CD8+ T细胞比例,降低调节性T细胞(Tregs)比例,增强肿瘤特异性CD8+ T细胞浸润。此外,cGAMP@vEVs显著抑制肿瘤生长、转移和复发,延长小鼠生存期,且未引起明显的肝肾功能损伤或病理组织变化。
综上,cGAMP@vEVs作为一种新型纳米疫苗,通过工程化细胞外囊泡实现了高效抗原递送和免疫激活,为癌症免疫治疗提供了新思路。
基本信息

题目:Engineered virus-mimicking nanovaccine with lymph node–tumor dual-targeting and STING-activating capacity for robust cancer immunotherapy
期刊:Journal of Controlled Release
影响因子:10.5
PMID:39694072
通讯作者:黄利利a 梅林c 吕桂红b 张帆c
作者单位:a北京理工大学医学技术学院;b深圳市儿童医院儿童保育与心理健康中心;c中国医学科学院&北京协和医学院生物医学工程研究所
索莱宝合作产品:
|
货号 |
名称 |
|
K109190P |
ActivAbTMAnti-CD47 Polyclonal Antibody |
|
K001677P |
ActivAbTMAnti-CD44 Polyclonal Antibody |
|
K002267P |
ActivAbTMAnti-CDH1 Polyclonal Antibody |
|
PC0020 |
BCA蛋白浓度测定试剂盒 |
摘要
癌症疫苗在肿瘤免疫治疗领域备受关注,但其疗效受限于细胞毒性T淋巴细胞(CTL)的增殖不足、活化不足及肿瘤浸润困难。受病毒成分的强免疫刺激特性及病毒感染诱导的免疫原性细胞死亡(ICD)中钙网蛋白暴露的启发,该研究开发了一种仿病毒纳米疫苗策略cGAMP@vEVs:通过病毒感染工程化肿瘤细胞来源的胞外囊泡,使其共同负载个性化/广谱抗原库及多种免疫佐剂,以高效激发抗肿瘤免疫。实验表明cGAMP@vEVs兼具优异的淋巴结-肿瘤双靶向能力和STING通路激活能力,可驱动淋巴结内肿瘤特异性CD8+ T细胞的增殖与活化;同时主动富集于肿瘤部位,改善免疫抑制性肿瘤微环境(TME),促进CTL的自发浸润。这种免疫响应与TME重塑的协同作用重启了癌症免疫的自循环,从而有效抑制肿瘤进展、转移与复发。
研究内容及结果
01
cGAMP@vEVs的制备及表征
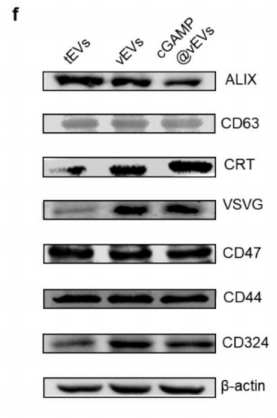
Western blot验证了vEVs中存在VSVG和CRT,而tEVs中不存在,尽管两者都表现出高水平的代表性CD63和ALIX蛋白,以及与肿瘤自身识别相关的CD324和CD47蛋白,还有4T1细胞的自身标记物CD44。vEVs的产量大约是tEVs的1.6倍,表明VSV感染促进了细胞外囊泡从其亲本细胞的产生。通过电穿孔将STING激动剂cGAMP加载到vEVs中,当vEVs与cGAMP的质量比为1:4时,加载达到饱和,最大加载效率约为14%。cGAMP@vEVs的尺寸在cGAMP加载后从100.04±1.70稳定增加到138.69±4.84。如图1g所示,cGAMP和VSVG在cGAMP@vEVs中很好地共定位(共定位效率:91.4%)。
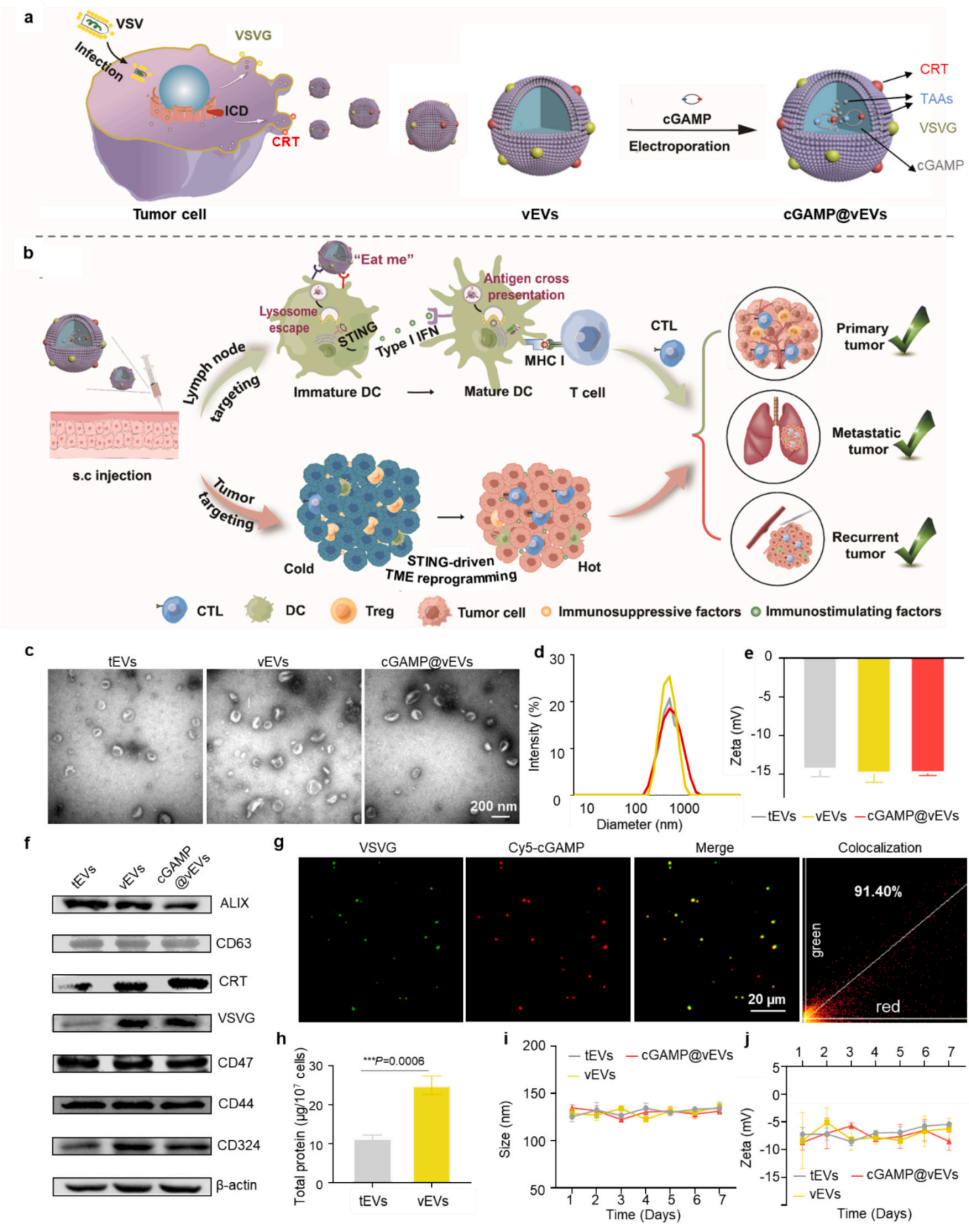
图1
02
cGAMP@vEVs被肿瘤细胞
和树突状细胞的靶向摄取
如图2a所示,与其他细胞系相比,同型4T1细胞在2小时孵育后显示出更多的cGAMP@vEVs(用4T1细胞的vEVs加载cGAMP)。定量分析表明cGAMP@vEVs处理的4T1细胞的平均荧光强度(MFI)大约是cGAMP@vEVs处理的HepG2(人肝细胞癌)、B16(小鼠黑色素瘤)、CT26(小鼠结肠癌)或HC11(小鼠正常乳腺)细胞的3-10倍。如图2c所示,与cGAMP@tEVs相比BMDCs显示出更多的cGAMP@vEVs。cGAMP@vEVs阳性BMDCs的百分比大约是cGAMP@tEVs阳性BMDCs的1.38倍,表明vEVs上的CRT显著增强了BMDCs对cGAMP的摄取效率。
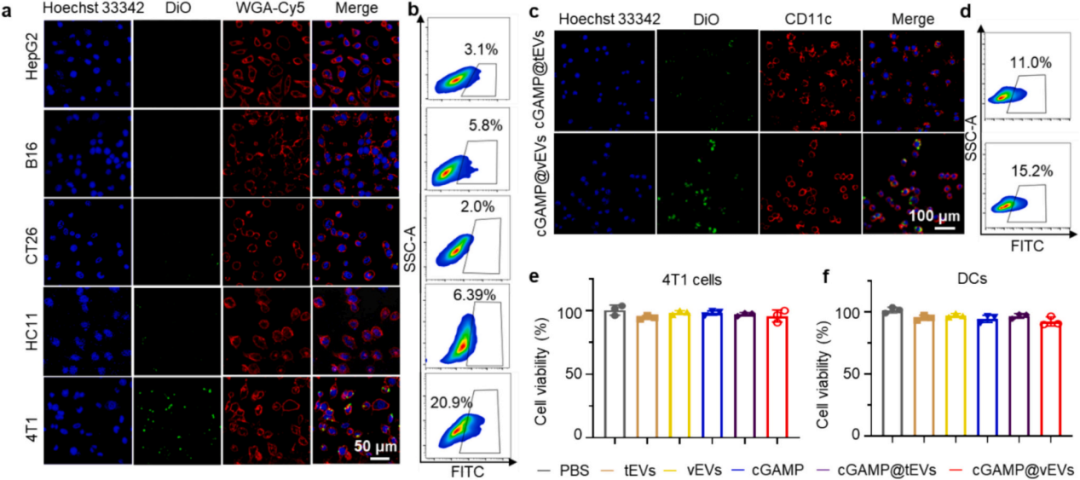
图2
03
STING通路激活与
肿瘤相关抗原交叉呈递
共聚焦成像和共定位效率分析表明大多数tEV递送的Cy5-cGAMP在与BMDCs共孵育6小时后与内质网和溶酶体共定位,而大多数vEV递送的Cy5-cGAMP分散在细胞质中。与单独用cGAMP或cGAMP@tEVs处理的BMDCs相比,用cGAMP@vEVs处理的BMDCs显示出显著增强的磷酸化IRF3和TBK1的表达。与cGAMP或cGAMP@tEV处理的BMDCs相比cGAMP@vEVs处理的BMDCs产生了最高水平的IFN-β(51.51±3.12 pg/mL),而cGAMP或cGAMP@tEV处理的BMDCs仅诱导了低或中等水平的IFN-β(分别为24.14±1.05和35.70±1.60 pg/mL)。此外,cGAMP@vEV处理导致同源肿瘤细胞中磷酸化IRF3和TBK1的表达增强。
如图3k-n所示,与cGAMP处理的BMDCs相比,cGAMP@vEVs处理的BMDCs中MHC-I和CD80CD86的表达水平显著上调,分别为1.94倍和1.62倍;与cGAMP@tEVs处理的BMDCs相比,分别为1.23倍和1.29倍,表明DC成熟。此外,cGAMP@vEVs诱导BMDCs产生最高水平的肿瘤坏死因子-α(TNF-α)和白细胞介素-6(IL-6)。在cGAMP@vEVs处理后观察到CD3+ CD8+ T细胞群中CD69+ T细胞的百分比增加,伴随着IFN-γ和颗粒酶B的产生增加,表明T细胞激活效率高。
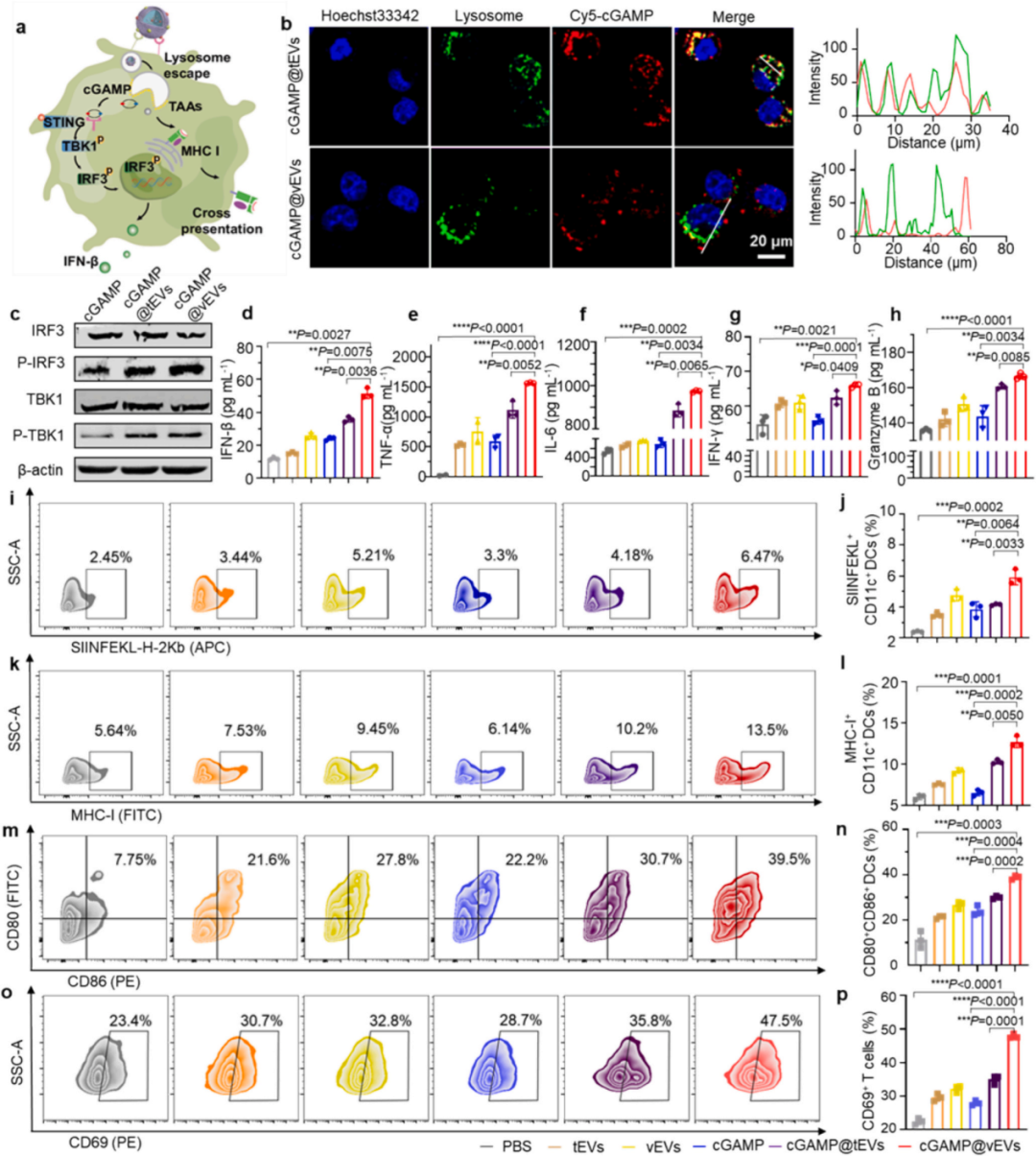
图3
04
体内肿瘤-淋巴结双靶向与免疫激活
DiR信号逐渐在肿瘤和LNs中积累,并在注射后48小时达到峰值;然而在正常组织中几乎检测不到。DiR标记的cGAMP@vEVs的峰值强度在肿瘤中与DiR标记的tEVs相当,而在LNs中大约是后者的两倍。大量cGAMP@vEVs在LNs中积累并与DCs共定位,证实cGAMP@vEVs能够有效地迁移到LNs并与DCs在体内特异性相互作用。
此外,与cGAMP@tEVs处理的小鼠相比cGAMP@vEVs处理的小鼠的LNs中包含更多的免疫细胞,这些共定位的DCs与CD4+和CD8+ T细胞高度共定位(共定位效率分别为99.6%和98.9%),表明潜在的T细胞激活。cGAMP@vEVs处理的小鼠的腹股沟LNs中DCs的CD80 CD86和MHC-II的表达水平最高,从12.1%和12.3%分别增加到40%和37.2%。与单独用cGAMP或cGAMP@tEVs处理的小鼠相比,cGAMP@vEVs处理的小鼠中DCs的MHC-I表达水平分别增加了1.59倍和1.14倍。此外,cGAMP@vEVs处理导致引流LNs中CD11c+SIINFEKL-H-2Kb+抗原交叉呈递DCs的最大水平。
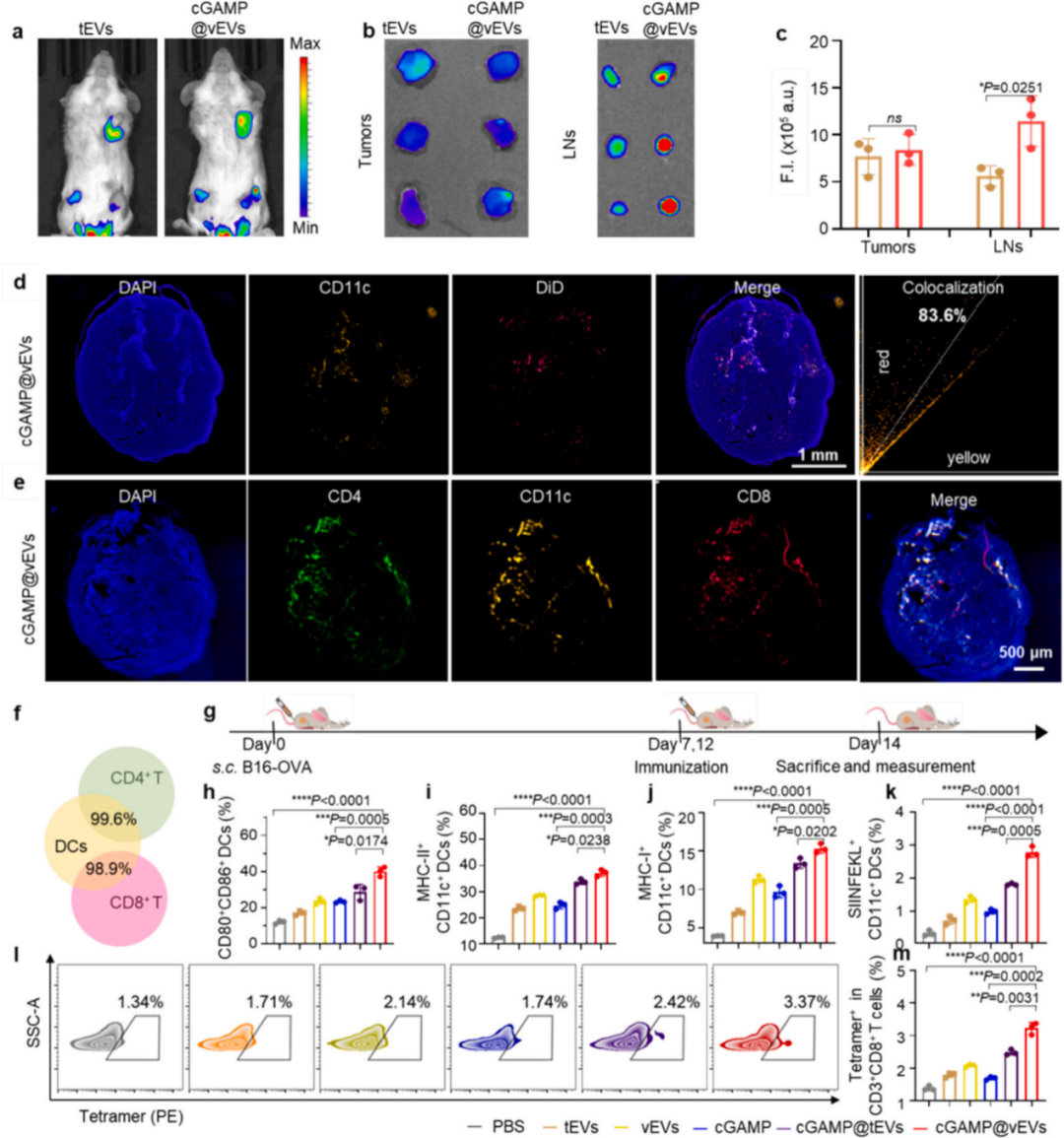
图4
05
肿瘤微环境调控与肿瘤进展抑制
与调节性T细胞(Tregs,CD25+Foxp3+)相比,CD4+(CD4+CD3+)和CD8+(CD8+CD3+)T细胞的百分比显著增加。cGAMP@vEVs注射导致肿瘤内CD8+和CD4+ T细胞与Tregs的比例分别增加了8.69倍和14.4倍。此外,cGAMP@vEV处理显著增加了肿瘤内CTLs(CD3+CD8+IFNγ+)的丰度。如图5h所示,与PBS组相比,用vEVs处理的肿瘤显示出许多免疫激活相关基因的上调表达,如CXCL10、CD40和TLR9,以及免疫抑制基因的下调表达,如MMP10和VEGFA。癌症促进因子如TGFB2和ARG1也被下调。
与PBS组相比,vEV处理组的细胞因子-细胞因子受体相互作用、Toll样受体信号通路和趋化因子信号通路显著激活。与单独用cGAMP、cGAMP + vEVs或cGAMP@tEVs处理的组相比,cGAMP@vEVs组显示出更明显的肿瘤生长抑制。此外,其他组的小鼠在45天内死亡;然而,>83%的cGAMP@vEVs组小鼠存活。
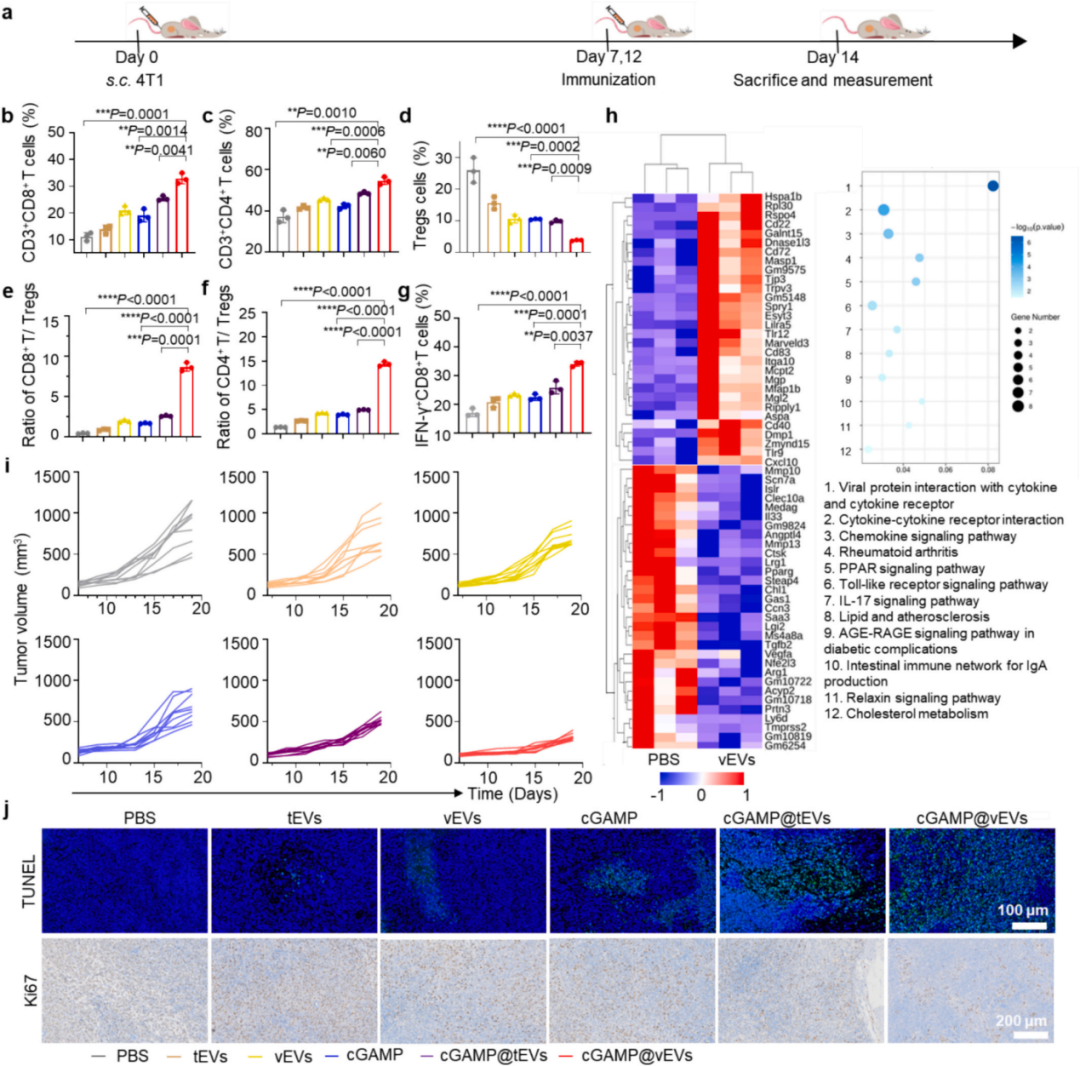
图5
06
抑制肿瘤转移和复发
如图6b所示,在用PBS、tEVs、vEVs、cGAMP或cGAMP@tEVs处理的小鼠中观察到明显的肺转移,而在用cGAMP@vEV处理的组中几乎未观察到转移。此外,cGAMP@vEV处理组的肺转移瘤数量和肺重量显著减少(图6c-d),突显了cGAMP@vEVs在抑制肿瘤转移方面的显著优势。
cGAMP@vEVs处理组显示出显著的肿瘤生长抑制和更长的存活时间,肿瘤抑制率为50.6%(图6f-h)。定量分析显示,cGAMP@vEVs处理组小鼠脾脏中肿瘤特异性CD8+ T细胞的百分比显著增加(图6i)。此外,与PBS对照组相比,cGAMP@vEVs处理组小鼠脾脏中的效应记忆T细胞(TEM)(CD3+CD8+CD62L-CD44+细胞)增加了27.9%(图6j-k)。
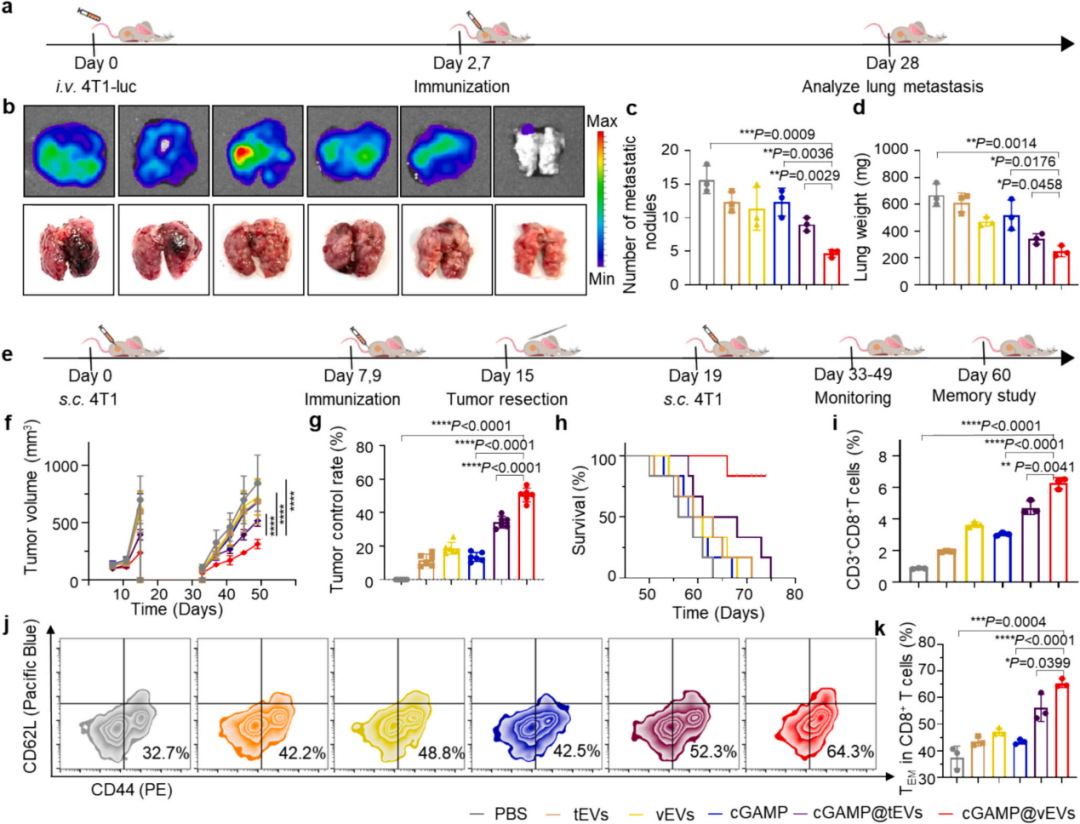
图6
结论
该研究创新性地利用水疱性口炎病毒(VSV)感染的工程化肿瘤细胞来源的胞外囊泡(vEVs),构建了一种仿病毒纳米疫苗cGAMP@vEVs。该疫苗通过VSV-G糖蛋白和钙网蛋白(CRT)的协同作用,实现了淋巴结与肿瘤组织的双重靶向:一方面激活淋巴结中的STING通路以促进T细胞活化与增殖,另一方面直接作用于肿瘤微环境以逆转免疫抑制状态。与传统疫苗相比,该策略突破性地实现了多肿瘤抗原与佐剂cGAMP的共递送,克服了单一抗原免疫原性不足的缺陷,在显著提升疫苗生物利用度的同时确保了良好的安全性特征。
从临床转化角度来看,该技术方案具有显著的实用优势。可快速制备个性化疫苗,其工艺流程相较于新抗原疫苗或过继性细胞治疗更为简便可靠,为肿瘤免疫治疗的临床推广提供了新的技术路径。然而,要实现该疗法的临床应用,仍需通过大型动物实验验证其规模化制备的稳定性,在患者来源异种移植(PDX)模型中系统评估其治疗效能,并建立规范的长期安全性评价体系。
索莱宝产品亮点


相关产品
SOLARBIO
|
货号 |
名称 |
|
K003025P |
ActivAbTMAnti-CD47 Polyclonal Antibody |
|
K010112M |
ActivAbTMAnti-CD47 Monoclonal antibody |
|
K115123P |
ActivAbTMAnti-CD44 Polyclonal Antibody |
|
K002758P |
ActivAbTMAnti-CD44 Polyclonal Antibody |
|
K007092P |
ActivAbTMAnti-CD44 Polyclonal Antibody |
|
K106561P |
ActivAbTMAnti-CADH1 Polyclonal Antibody |
|
K111304P |
ActivAbTMAnti-CDH1/2/3/4 Polyclonal Antibody |
|
K115158P |
ActivAbTMAnti-CDH1 Polyclonal Antibody |
|
SE131 |
ActivAbTM羊抗小鼠IgG-HRP |
|
SE134 |
ActivAbTM羊抗兔IgG-HRP |
|
K1031G-AF594 |
ActivAbTMSolar Fluor 594标记的羊抗小鼠IgG |
|
SF134 |
ActivAbTM羊抗兔IgG-FITC |
